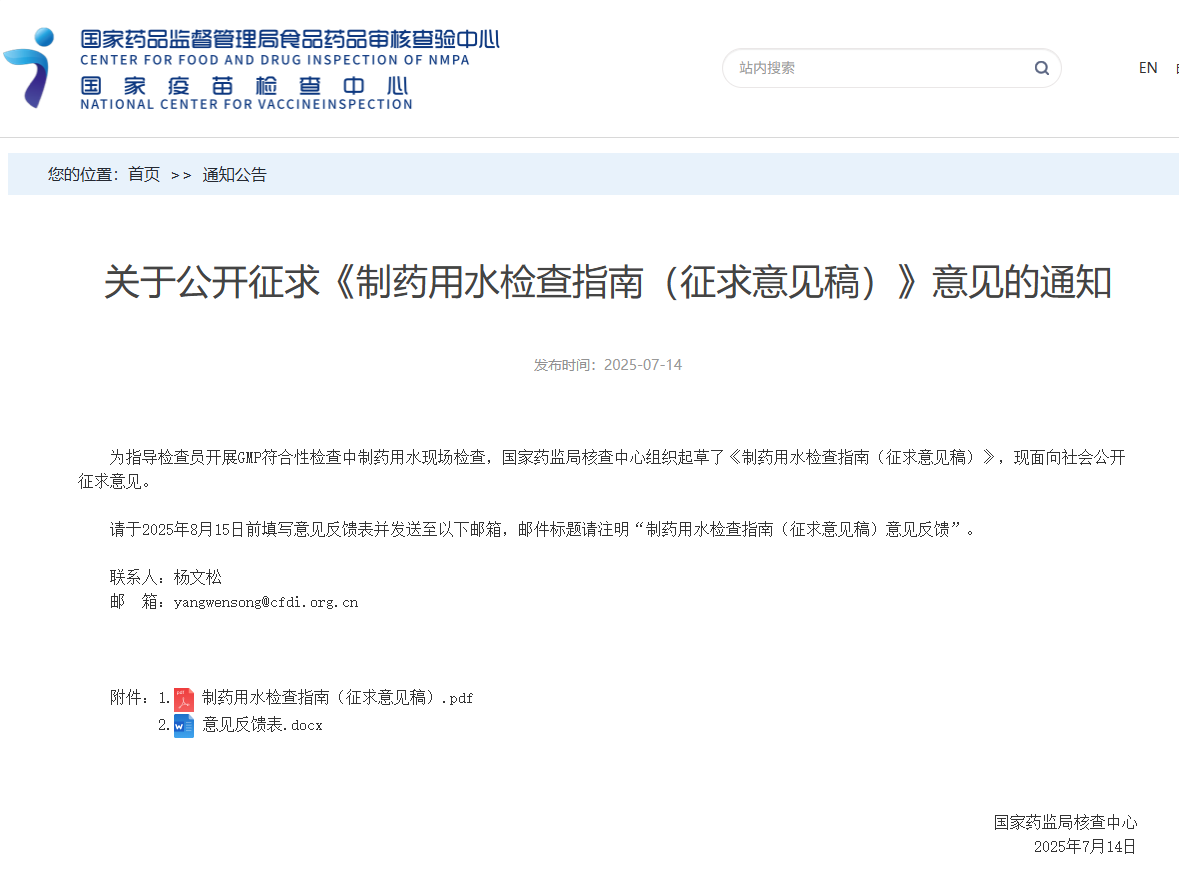
电话:021-3178-5055
邮箱:yiyao-marketing@weipugroup.com
本网站内容中提及的资质、荣誉等相关数据
来源:本网站中提及的各项业务,由拥有相应业务资质的微谱科技集团旗下分子公司及其关联公司承接;其中知识产权服务业务由上海微略知识产权代理有限公司进行代理(机构代码:31498)。
2025年7月14日,国家药品监督管理局食品药品审核查验中心发布了关于公开征求《制药用水检查指南(征求意见稿)》意见的通知。确保制药用水质量符合最新指南要求,是相关企业实现高效运营的重要步骤。本期推文,微谱GMP验证服务专家将带来《制药用水检查指南(征求意见稿)》检测环节的最新要点解读。

1 纯化水(PW)
必检项目:电导率、TOC、微生物;若用于无菌后续步骤,需检测内毒素。
标准:符合《中国药典》纯化水项下的规定。
2 注射用水(WFI)
必检项目:电导率、TOC、微生物、细菌内毒素。
标准:符合《中国药典》注射用水项下的规定。
非蒸馏法:需提供等效蒸馏验证数据(≥3 个月并行比对)。
3 纯蒸汽
必检项目:冷凝水按 WFI 限度执行;湿热灭菌用汽需检测不凝性气体(≤3.5%)、过热度(≤25°C)、干燥度(≥0.95)。
标准:冷凝水符合《中国药典》注射用水标准。

1
验证期
第一阶段:至少 2 周,每点每日全检。
第二阶段:至少 2 周,每点每日全检,数据用于生产。
第三阶段:至少12个月(含第1和2阶段),涵盖不同季节,日常监测频率降低。
2 日常监测
频次:每日至少 1 个代表性使用点全检。
最差条件位点:纳入年度回顾。
在线-离线数据一致性:确保在线监测与离线检测结果一致。

1 数据完整性
电子记录:包含审计追踪,确保数据可追溯。
警戒/纠偏限:基于验证数据动态更新。
2 偏差管理
OOS/偏差:24 小时内启动调查,CAPA 闭环管理。

1 微生物、内毒素
可采用经验证的快速检测方法,但需与传统方法建立定量相关性,并保留全部原始数据。

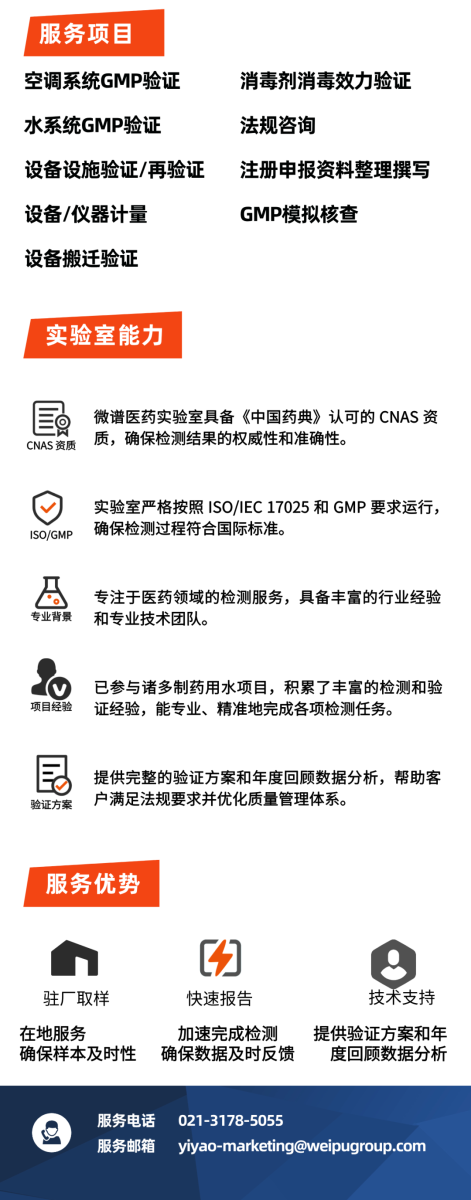
关于公开征求《制药用水检查指南(征求意见稿)》意见的通知
发布时间:2025-07-14
为指导检查员开展GMP符合性检查中制药用水现场检查,国家药监局核查中心组织起草了《制药用水检查指南(征求意见稿)》,现面向社会公开征求意见。
请于2025年8月15日前填写意见反馈表并发送至以下邮箱,邮件标题请注明“制药用水检查指南(征求意见稿)意见反馈”。
联系人:杨文松
邮 箱:yangwensong@cfdi.org.cn
国家药监局核查中心
2025年7月14日

关于我们
微谱于2014年正式涉足生物制品服务领域,立足于生物医药全产业链,依托创新型自主知识产权体系构建出成熟的生物制品质量研究平台、生物安全服务平台、动物实验服务平台、NGS合规检测平台、GMP验证服务平台、药品包材理化服务平台以及药械知识产权服务平台,致力于为国内外生物药企业提供合规、专业、一体化的生物制品质量与安全研究综合解决方案。
更多详情 · 请联系
电话:021-3178-5055
邮箱:yiyao-marketing@weipugroup.com